| Мутації |
|---|
| Додаткові коментарі |
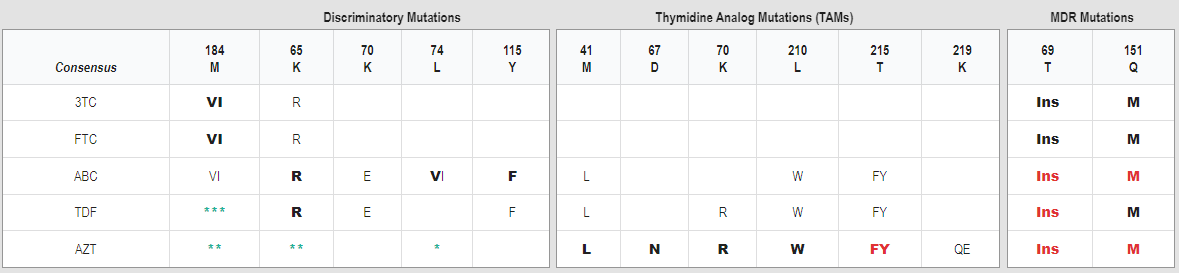
Таблиця містить найбільш поширені клінічно значимі мутації резистентності до НІЗТ. Мутації, позначені червоним шрифтом, асоційовані з найвищим ступенем зниження чутливості або вірусологічної відповіді на відповідні НІЗТ. Мутації, позначені жирним шрифтом, самі по собі зменшують чутливість до НІЗТ. Мутації, позначені звичайним текстом, призводять до зменшення чутливості вірусу в комбінації з іншими мутаціями резистентності до НІЗТ. Існує шість широко використовуваних НІЗТ: цитидинові аналоги 3TC та FTC (сумісно називаються ХТС), проліки TFV - TDF та TAF, ABC та AZT. НІЗТ найчастіше використовуються у наступних двокомпонентних комбінаціях: AZT/3TC, ABC/3TC, TDF/XTC та TAF/XTC. Однак, XTC найчастіше використовується окремо в комбінації з якірним препаратом, що має вищий генетичний бар’єр до резистентності, такими як DTG чи DRV/r. Оцінка антивірусної активності НІЗТ та втрата цієї активності внаслідок появи мутацій резистентності вірусу до НІЗТ ускладнена у зв’язку з кількома причинами. По-перше, НІЗТ – це про-ліки, які повинні бути три-фосфорильовані (у випадку XTC, AZT таABC) або ди-фосфорильовані (у випадку TFV) до їхніх активних форм, і кінетика НІЗТ-фосфорилювання варіює в значних межах в залежності від типу клітин. По-друге, динамічний діапазон кратності рівнів резистентності, порівняно з диким штамом вірусу, варіює в значних межах в середині класу НІЗТ від >200-кратної для AZT та XTC і зазвичай менш, ніж 5-10-кратної для TFV та ABC. По-третє, кілька мутацій резистентності до НІЗТ асоційовані з помітним зменшенням рівня вірусної реплікації, особливо M184V/I та K65R. Насамкінець, M184V/I збільшує чутливість до AZT та TFV, в той час як K65R збільшує чутливість до AZT. В цьому резюме наведені кратності зменшення чутливості вірусу при наявності індивідуальних мутацій та комбінацій мутацій, визначені в аналізі PhenoSense (Monogram BioSciences), оскільки цей аналіз є високоточним та відтворюваним, а зменшення чутливості вірусу низького рівня клінічно значимі для потому для TFV та ABC (1). Більше того, існує величезна кількість таких даних, доступних для більшості мутацій резистентності до НІЗТ. Однак, клінічна значимість різних рівнів зниження чутливості вірусу до НІЗТ часто достеменно не відома. Найбільше зниження чутливості до XTC спричиняється мутацією M184V/I, що знижує чутливість вірусу більше, ніж 200-кратно. Багато мутацій резистентності також зменшують чутливість вірусу до XTC, хоча і в набагато меншому ступені. Наприклад, присутність трьох і тимідин-аналогових мутацій (TAMs) або K65R зменшує чутливість XTC у 5-10 разів. Враховуючи потужність XTC, клінічна значимість цих мутацій на клінічну ефективність XTC невизначена. Хоча AZT теж має широкий динамічний діапазон, незначне зниження чутливості (наприклад 5-кратне, що спостерігається при наявності поодинокої мутації K70R ) вважається клінічно значимим, імовірно тому, що по своїй природі AZT менш потужний НІЗТ in vivo. Monogram BioSciences звіт містить інформативні клінічні граничні значення, асоційовані з ABC та TDF. До них відноситься нижній поріг кратності рівня резистентності , вище якого антивірусна активність, імовірно, буде знижена у порівнянні з активністю препарату до дикого штаму вірусу, і верхній поріг, нижче якого, як вважається, НІЗТ має незначну остаточну противірусну активність . Нижній і верхній пороги ABC - 4.5 та 6.5 -були отримані в дослідженнях, де повідомлялося про використання схеми терапії з включенням АВС у осіб, від яких були виділені віруси, що містили одну чи більше TAM. Нижній і верхній пороги TDF - 1.4 та 4.0 - були отримані з дослідження, в якому TDF був доданий до існуючої схеми терапії у осіб, з крові яких були виділені віруси, що мали одну чи більше TAM. Дослідження, в яких були визначені зазначені пороги, були представлені на наукових конференціях і не були опубліковані у вигляді рукописів. Дані щодо статистичної достовірності вказаних порогових значень також не були опубліковані. Тим не менше, ці значення забезпечують важливий контекст для оцінки клінічної значущості зниження чутливості до ABC і TDF. Два великі дослідження використання LPV/r плюс два препарати НІЗТ для терапії другої лінії показали, що навіть коли результати генетичних досліджень з визначення резистентності ВІЛ свідчать про обмежену противірусну активність НІЗТ, тим не менше, препарати мають значну противірусну дію. Це спостереження свідчить, що у осіб, які не приймали інгібітори протеази, призначення LPV/r потребувало лише незначної додаткової противірусної активності для отримання успішного противірусного впливу. Дослідження NADIA, яке оцінювало використання двох НІЗТ плюс або DTG, або DRV/r прийшло до аналогічних висновків. Особливе значення має те, що основа НІЗТ у вигляді TDF/3TC була такою ж ефективною, як AZT/3TC на 48 тижні, та більш ефективною, ніж AZT/3TC на 96 тижні, незважаючи на те, що близько половини осіб, які були включені у дослідження, мали віруси з мутацією K65R, яка зменшує чутливість до TDF але збільшує чутливість до AZT. Комбінація TDF/3TC був також більш ефективною, ніж AZT/3TC у профілактиці появи мутацій резистентності до НІЗТ у осіб, які одночасно лікувалися DTG. Це відкриття могло бути результатом початково зниженої активності AZT у порівнянні з TDF і тому що прихильність до AZT/3TC може бути нижчою у зв’язку з необхідністю приймати препарати двічі на день. TAF-вмісні схеми можуть бути більш ефективними, ніж TDF-вмісні схеми у лікованих осіб, від яких виділяють віруси, що містять мутації резистентності до НІЗТ. По-перше, в ході фаз II та III дослідження, спостерігалося 4-5-кратне збільшення TFV-дифосфату в РВМС у порівнянні з TDF-дифосфатом. По-друге, 10-денний курс монотерапії TAF по 25 mg був асоційований з на 0.5log10 більшою редукцією рівня РНК ВІЛ-1 в плазмі у порівнянні з терапією TDF 200 mg (1.46 проти 0.97 logs). По-треті, при оцінці фізіологічної концентрації, що досягається TDF та TAF, TAF був більш ефективний у профілактиці спалахів вірусної продукції під час експериментів з пасажами клінічних ізолятів, що мітили кілька типів мутацій стайкості до TFV, включаючи два ізоляти, що мали три ТАМ, ізолят з K65R, ізолят з K65R+M184V та ізоляти з кількома іншими типами мутацій.
M184V/I мутації, що селектуються при прийомі 3TC/FTC і зменшують чутливість вірусу до цих препаратів > ніж у 200 разів. M184V/I також селектується під впливом АВС і зменшує чутливість вірусу до нього приблизно в 3 рази. На противагу цьому, M184V/I майже вдвічі збільшує чутливість вірусу до AZT та TFV та уповільнює розвиток резистентності до цих препаратів. M184V/I асоційовані зі зменшенням рівня вірусної реплікації in vitro та in vivo. M184I як правило з’являється перед M184V, оскільки є результатом більш звичної заміни нуклеотидів (38). Однак, M184V заміщає M184I упродовж кількох тижнів вірусної реплікації і виявляється у більшості пацієнтів з вірусологічної невдачею АРТ, які отримують 3TC або FTC (39,31). Повідомляється, що мутація M184V/I була виявлена у 1% осіб з вперше діагностованою інфекцією ВІЛ-1 в США і в усьому світі. M184L та M184T нечасті мутації, що виявляються переважно у осіб, які приймали НІЗТ з частотою близько 0.1%. T часто присутня у комбінації з M, а L у комбінації з V. Дослідження з моделювання показають, що вони пов’язані з і зниженою здатністю до реплікації.
K65R відбирається на фоні прийому TFV, ABC, і, рідше, 3TC. K65R селектується обома TFV про-ліками і має схожий ефект на чутливість до TAF як і на TDF. Вона зменшує чутливість до TFV та ABC приблизно у 2 рази відповідно до результатів дослідження PhenoSense, і трохи більше відповідно до результатів інших досліджень. K65R зменшує чутливість до 3TC та FTC приблизно в 5 -10 разів. Клінічна значущість цих змін не відома, оскільки ця зменшення чутливості набагато менше ніж зменшення у 200 разів, що спричиняється M184V/I. K65R збільшує чутливість вірусу до AZT, за виключенням тих випадків, коли вони зустрічаються у комбінації з Q151M. K65R рідко зустрічається у комбінації з TAM, тому що K65R і більшість TAM проявляють двонаправлений антагонізм. З більшою імовірністю K65R з’являється частіше у вірусів з субтипом C. По-перше, біохімічні дослідження показали, що унікальні ділянки послідовності субтипу С в районі K65R, зокрема діапазон п'яти послідовних аденозинів, що передують аденозину на другій позиції в кодоні К65 – підвищують імовірність появи мутації саме в цих ділянках під час зворотної транскрипції. По-друге, K65R з’являється швидше під час пасажів in vitro вірусів підтипу С, ніж вірусів підтипу В, у присутності TFV. По-третє, два ретроспективні дослідження показали, що пацієнти, інфіковані вірусом з субтипом С, у яких розвивається вірусологічна неефективність при отриманні TFV-вмісних схем, мають вищий ризик розвитку K65R. Проте, незалежно від субтипу, K65R більш поширена НІЗТ-асоційована мутація ніж M184V, що формується у вірусів, виділених від пацієнтів, які отримують TDF-вмісні схеми. Також не було виявлено ніяких доказів, що пацієнти, інфіковані вірусом з субтипом C мають вищий ризик щодо розвитку вірусологічної неефективності на TDF-вмісних схемах. M184V/I сама по собі і комбінація K65R + M184V/I два найбільш поширених паттерни мутацій резистентності до НІЗТ, що з’являються у пацієнтів, які мають вірусологічну неефективність на НІЗТ-вмісних схемах першої лінії терапії, рекомендованих ВООЗ. Серед послідовностей у базі даних, які мають ці мутації, при фенотипуванні у дослідженні PhenoSense було визначено зниження чутливості до AZT в 0,4 рази, до TFV – в 1,2 рази, до ABC - в 8,4 разів, і більше ніж у 200 разів до 3TC/FTC. Попри зростання чутливості до AZT, що асоційоване з цим паттерном, комбінація TDF/3TC була асоційована зі зменшеним ризиком розвитку вірусологічної невдачі порівняно з AZT/3TC на 96 тижні терапії за результатами дослідження NADIA. Ризик появи резистентності до DTG на 96 тижні був також нижче серед пацієнтів, що отримували TDF/3TC/DTG (3 із 233 осіб) у порівнянні з тими, хто отримував AZT/3TC/DTG (6 із 231 осіб). K65N це незвична мутація, що селектується при терапії d4T, TDF та ABC,та in vitro комбінацією TDF/FTC. Вона пов’язана з більшим зниженням реплікативної здатності, ніж K65R. Базуючись на обмежених даних, її поява була асоційована з приблизно 2-кратною редукцією чутливості вірусу до TFV та ABC, і 5-кратним зниженням чутливості до 3TC. K65E надзвичайно рідкісна мутація, що пов’язана з прийомом НІЗТ, та негативно впливає на фітнес вірусу, вона зазвичай виявляється у складі електрофоретичної суміші з вірусами, що відносяться до дикого субтипу К. У зв’язку зі зниженою реплікативною здатністю вірусів, що містять цю мутацію, її не можливо вивчити у фенотипових дослідженнях .
TAM – неполіморфні мутації, що селектуються на тлі прийому аналогів тимідину AZT та d4T. Вони зменшують чутливість до НІЗТ, полегшуючи розблокування праймерів (тобто, відокремлення нуклеотидів, пірофосфороліз). Класичні ТАМ— M41L, D67N, K70R, L210W, T215Y/F та K219Q/E — були вперше описані у пацієнтів, що отримували монотерпію AZT. Є кілька додаткових мутацій, що селектуються при терапії AZT і d4T, які та/або сприяють розблокуванню праймерів, включаючи зворотні мутації T215, додаткові варіанти амінокислот у класичних положеннях ТАМ та додаткові мутації в інших положеннях.
Сама по собі T215Y відповідає за зниження чутливості вірусу до AZT в 7 разів та до ABC and TDF в 1,5 рази; відповідно до незначної кількості даних мутація T215F має менший вплив на AZT, ABC та TFV , ніж T215Y. M41L зазвичай з’являється у комбінації з T215Y. Ця комбінація спричиняє зменшення чутливості вірусу до AZT у 12 разів та до АВС та TFV у 2 рази. L210W зазвичай зустрічається у комбінації з M41L та T215Y. Ця комбінація спричиняє зниження чутливості вірусу до AZT у більше, ніж 100 разів, та до ABC та TFV - приблизно у 3 рази. K70R асоційована з приблизно 5-кратним зменшенням чутливості вірусу до AZT, та мінімальним, якщо таке взагалі є, зниженням чутливості до ABC та TFV. забезпечує резистентність середнього рівня до AZT і низького рівня до d4T та TDF. D67N зменшує чутливість вірусу насамперед до AZT. У комбінації з іншими ТАМ вона також асоційована зі зниженою чутливістю вірусу до ABC та TFV. K219Q/E знижує чутливість вірусу до AZT у комбінації з іншими TAM.
У пацієнтів, первинно інфікованих штамами вірусу, які мають мутацію T215Y/F, часто формуються штами, що несуть наступні реверсивні мутації: T215C/D/S, внаслідок заміни TAT/C (Y) на TGT/C (C), GAT/C (D), чи TCT/C (S); T215I/V внаслідок заміни TTT/A (F) на ATT/A (I) чи GTT/A (V; T215E внаслідок вторинних реверсивних замін GAT/C (D) на GAA/G (D). Теоретично, деякі АРТ-наївні пацієнти, інфіковані штамом вірусу, що має реверсивні мутації T215, можуть мати вищий ризик розвитку вірусологічної невдачі на AZT-вмісній першій схемі терапії, тому що на відміну від треоніну, що знаходиться в даній позиції у дикого штаму, більшості штамів з реверсивною мутацією достатньо лише однієї заміни пари нуклеотидів для того, щоб сформувалася мутація T215Y/F, і тому, що присутність штамів з реверсивною мутацією, виявлена при стандартному секвенуванні, може свідчити про те, що присутність у мінорних популяціях таких штамів, що містять мутацію T215Y/F. Однак, на практиці, мутацію T215Y/F при глибокому секвенуванні як правило не виявляють у осіб, у яких вірусна популяція має ревертанти T215Y/F, можливо тому, що T215Y/F мають знижений рівень реплікативної активності у порівнянні з ревертантами, і їх рівень в популяції знижається до низьких рівнів після передачі. Ревертанти T215 не були пов’язані з вірусологічною невдачею у осіб, які отримують сучасні TFV-вмісні схеми лікування першої лінії.
D67G/E та K219N/R також селектуються під впливом AZT і, очевидно, призводять до зниження чутливості до НІЗТ у комбінації з іншими TAM. На відміну від K70R, K70E/G/Q/T/N/S не відносяться до ТАМ.
E40F, E44D/A та V118I – мутації, що селектуються під впливом аналогів тимідину, спричиняють зниження чутливості до НІЗТ насамперед у поєднанні з іншими ТАМ. V118I є поліморфічною заміною і зустрічається у 2-5% пацієнтів, які не отримували АРТ. E40F та E44D/A, та в меншій мірі E44D, є неполіморфічними. K43Q / N, E203K, H208Y, D218E, K223Q/E та L228H/R є неполіморфічними НІЗТ-асоційованими мутаціями, які зазвичай виникають у поєднанні з безліччю інших TAM, вони вивчені недостатньо.
A62V зазвичай виникає у вірусів із субтипом A6, але також належить до неполіморфних. Вона найчастіше серектується у комбінації з K65R і часто у комбінації з мутаціями мультинуклеозидної резистентності Q151M та інсерціями T69. Вона коригує дефіцит реплікативної активності, пов'язаний з К65R і мутаціями мультинуклеозидної резистентності.
K70E/G/Q/T/N неполіморфічні мутації, що селектуються у пацієнтів, які отримують TFV і в значно меншій мірі та ABC-вмісні схеми. Ці мутації спричиняють мінімальне зменшення чутливості вірусу до ABC та TDF, відповідно до дослідження PhenoSense. Інші незвичні зміни в цих позиціях - K70S і делеція в кодоні 70. K70-делеція має вплив, схожий на вплив поодинокої амінкислотної заміни в позиції 69. Сама по собі вона має незнаний вплив на чутливіть до НІЗТ. Коли K70E та K65R зустрічаються в одному зразку, одна чи обидві присутні у різних частинах популяції вірусу, бо ці дві мутації антагоністичні.
L74V зазвичай зустрічається у штамах вірусів, виділених від пацієнтів, які отримують ABC, а також інколи у пацієнтів, які приймають TDF/XTC. Комбінація L74V + M184V є найпоширенішою у пацієнтів, які отримують ABC/3TC. Ця комбінація зменшує чутливість до ABC приблизно у 5 разів. L74V збільшує чутливість до AZT, а терапія із застосуванням AZT чинить селективний тиск, спрямований проти формування цієї мутації. L74V також зменшує чутливість вірусу до TFV, однак тим не менше, вона зрідка трапляється у осіб, які отримують TDF/XTC. L74I відбирається переважно при терапії ABC та зрідка TDF/XTC. У комбінації з M184V вона зменшує чутливість вірусу до АВС приблизно в три рази. У осіб, які отримують TDF-вмісні схеми терапії, вона компенсує знижену реплікативну здатність вірусу, пов’язану з M184V/I. L74V/I також сприяє збільшенню реплікативної здатності вірусу, який містить мутації резистентності до НІЗТ.
Y115F селектується in vitro та у пацієнтів при терапії ABC та TDF. Сама по собі Y115F зменшує чутливість до ABC в ~ 3 рази, але має мінімальний фенотиповий вплив на чутливість до TFV. Y115F сприяє зменшенню чутливості до TFV у комбінації з K65R.
Q151M насамперед відбиралася під впливом ранніх ННІЗТ - AZT та ddI. Вона стала вкрай рідкісною при використанні поточних 3ТС та FTC-вмісних НІЗТ-комбінацій. Зазвичай вона зустрічається у комбінації з двома або більше наступних з чотирьох додаткових мутацій: A62V, V75I, F77L та F116Y. За таких умов Q151M надає високий рівень резистентності до AZT та ABC, та резистентність середнього рівня до 3TC, FTC та TFV. Q151L це вкрай рідкісна мутація з високим рівнем пригнічення вірусного фітнесу, що селектується під впливом НІЗТ. Хоча вона, імовірно, не знижує рівень чутливості до НІЗТ, вона є перехідним етапом від дикого штаму вірусу до штаму, що містить Q151M.
Інсерції і делеції в області петлі, розміщеній між третім і четвертим бета-ланцюгами ферменту зворотної транскриптази, в першу чергу селектувалися під впливом ранніх НІЗТ, AZT та ddI. Вони стали вкрай рідкісними при використанні поточних 3ТС та FTC-вмісних НІЗТ-комбінацій. Beta3-Beta4 інсерції, що з’являються в будь-якій позиції між 67 та 70 кодонами, умовно віднесені до позиції 69. Ці інсерції, як правило, місять заміну T69S, за якою слідують дві додаткові амінокислоти. Інсерції T69 зазвичай зустрічаються у комбінації з множинними ТАМ, і, в такому супроводі, вони можуть спричиняти 1-20-кратне зниження чутливості до 3TC та FTC та резистентність високого рівня до інших НІЗТ. Інсерції T69 – це мутації, асоційовані із найбільшим зниженням чутливості до TFV. Найбільш поширені делеції Beta3-Beta4 зустрічаються в позиціях 67, 69 та 70. Делеція у позиції 67 як правило зустрічається у комбінації з незвичайною мутацією T69G та або з Q151M, або з множинними TAM. Віруси з делеціями і позиції D67 зазвичай мають високий рівень резистентності до AZT та зниження чутливості низького рівня до ABC та TFV. Делеції T69 – це рідкісні мутації, які зазвичай зустрічаються у комбінації з K65R у осіб, які отримують d4T/3TC, ABC/3TC та TFV/3TC. Самі по собі вони, імовірно, мають мінімальний вплив, схожий з впливом T69 делецій. Делеція S68, поява якої описана при пасажах вірусу in vitro при дослідженнях НІЗТ, однак її вплив на чутливість вірусу не достатньо охарактеризований.
S68G це поліморфна мутація, що селектується під впливом TDF та зустрічається з частотою до 5% у НІЗТ-наївних пацєнтів та до 10% у осіб, що отримували лікування TDF. Було показано, що вона посилює реплікацію вірусів, що містять K65R. S68N – це неполіморфна мутація, що селектується під впливом TDF in vitro та in vivо. ЇЇ вплив на чутливість до НІЗТ невизначений.
T69D - це неполіморфна додаткова мутація, що селектується під час прийому НІЗТ та, насамперед, знижує чутливість вірусу до ddI та, імовірно, d4T. T69S/N це в якійсь мірі неполіморфна додаткова мутація, що зазвичай зустрічається у комбінації з іншими ТАМ. T69D/S/N не призводить до зниження чутливості до AZT, ABC або TFV. T69G надзвичайно рідкісна неполіморна мутація, яка як правило зустрічається у вірусів, що мають ТАМ та делецію D67.
T74P неполіморфна додаткова мутація, що формується на фоні прийому ІП та зустрічається переважно у штамах вірусу, виділених від пацієнтів, які приймали різні ІП. Вона асоційована з мінімально зменшеною чутливістю до ATV and DRV. В генотиповій шкалі вона була однією з 11 мутацій, асоційованих зі зниженою вірусологічною відповіддю на лікування DRV-вмісними режимами, при комбінації з іншими мутаціями резистентності до DRV. T74S це додаткова мутація, що селектується при прийомі ІП, вона неполіморфна у більшості вірусів не-В-субтипів.
V75T/M/A/S неполіморфні додаткові мутації, що селектуються під впливом НІЗТ. V75T селектується переважно d4T та ddI і зменшує чутливість до цих НІЗТ та можливо АВС. V75M селектується у пацієнтів, які отримують схеми АРТ, що містять d4T та 3TC, особливо у вірусів з генотипом CRF01_AE. V75S/A рідкісна мутація, що селектується під впливом НІЗТ, її фенотипова значимість не визначена.
N348I це неполіморфна додаткова мутація, що селектується під впливом НІЗТ - AZT та d4T та ННІЗТ - NVP та EFV. Сама по собі ця мутація зменшує чутливість до AZT, NVP та EFV приблизно в 2 рази. Вона полегшує розблокування праймеру за рахунок зниження швидкості деградації матриці РНК.